免疫疗法通过调动机体的免疫系统,从而抑制和杀伤肿瘤细胞,在当前临床肿瘤治疗中表现出巨大的潜力,但患者低响应率和不可预测的免疫相关不良事件(irAEs)限制了肿瘤免疫疗法的进一步发展。焦亡是一种基于Gasdermine (GSDM)蛋白家族的新型程序性细胞死亡模式,可在化疗、光疗等作用下诱发强烈的炎症反应,进而激活和放大免疫系统,有效提升抗肿瘤免疫疗法的治疗效果。然而,细胞焦亡的非特异性诱发和免疫抑制肿瘤微环境等问题限制了其广泛应用,发展可解决上述技术瓶颈的纳米药物系统是改善焦亡介导的肿瘤免疫疗法性能的重要途径。
为了解决上述问题,我室许志刚教授团队近日设计了一类内源/外源刺激响应的单分子聚前药作为纳米诱导剂(CCNP),用于调控GSDME蛋白介导的肿瘤细胞焦亡过程,进而增效肿瘤免疫治疗效果。聚前药是一类具有高载药率、选择性匹配肿瘤微环境、可释放出原始药物分子等特性的药物递送载体。与传统两亲性聚前药相比,单分子聚前药具有更高的胶束稳定性和小尺寸分布,可有效提高药物递送效率和调控肿瘤微环境,进而提高肿瘤治疗效率。作者首先利用多引发位点的ATRP聚合反应,合成了一类基于β-环糊精的单分子聚前药,用于联合递送化疗药物喜树碱和光敏剂二氢卟吩e6(Ce6)。该聚合物纳米诱导剂可被无创激光辐射与肿瘤微环境活性氧(ROS)和谷胱甘肽(GSH)特异性激活,可控释放出光敏剂与化疗药物分子,共同激活Caspase-3和调控肿瘤细胞焦亡的发生,并结合PD-1 疗法产生可消除远端肿瘤的全身免疫反应,有效延长了小鼠生存周期。这种三管齐下的焦亡诱导策略可充分发挥纳米诱导剂输出的化疗与光动力联合治疗的疗效,为多刺激响应纳米药物诱导并精确调控肿瘤细胞焦亡辅助免疫检查点阻断治疗提供了新的视角(图1)。相关研究成果以标题为“Endogenous/Exogenous Stimulies Inspired Polyprodrug Nano-Inducer Switches Pyroptosis Path for Promoting Antitumor Immunity”发表在国际知名期刊 《Nano Today》上(IF=18.962)。该研究得到了国家自然科学基金、重庆英才计划-青年拔尖人才和重庆市留学人员回国创业创新支持计划等项目的支持。
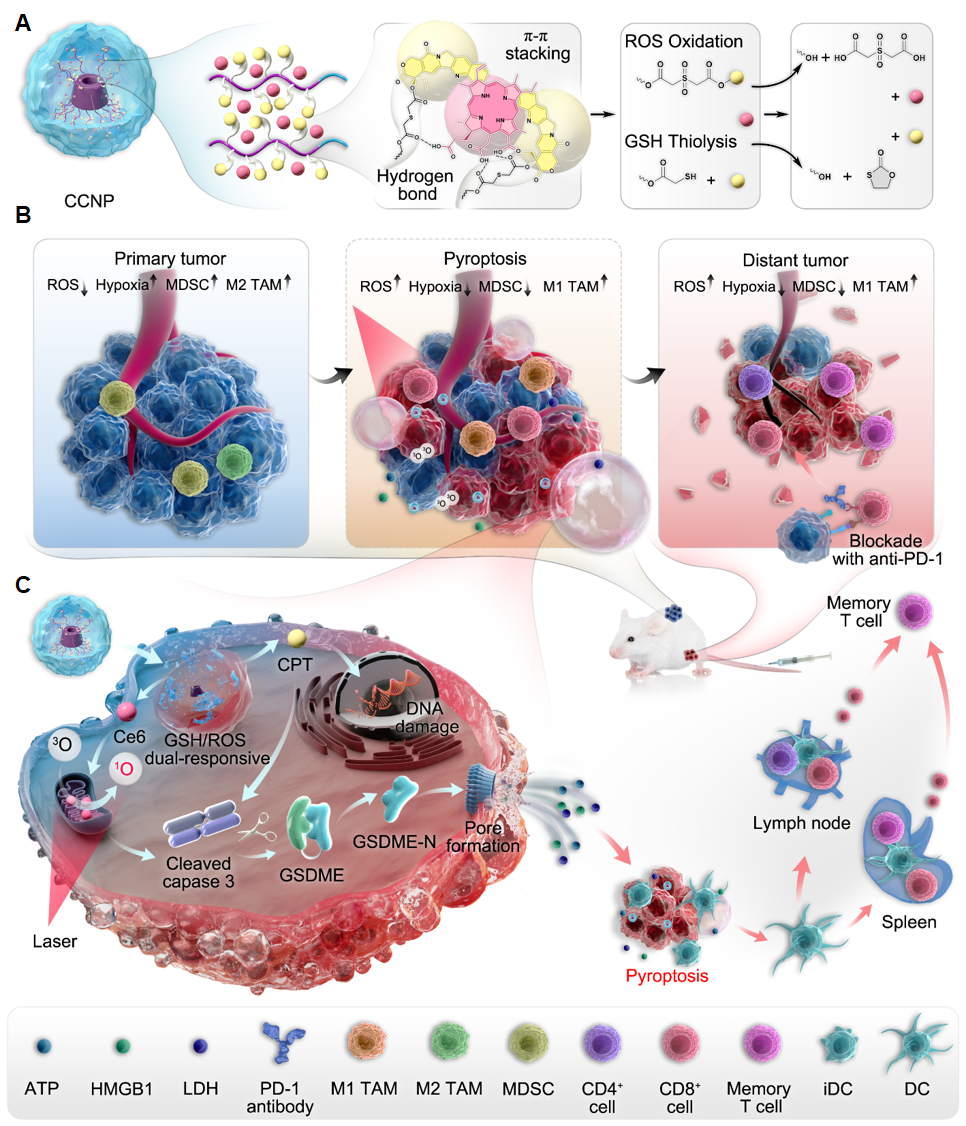
图1. CCNP通过化学调控肿瘤微环境和诱导肿瘤细胞焦亡来改善抗肿瘤免疫应答。
上述工作是许志刚教授团队近期关于聚合物纳米药物增效肿瘤免疫治疗的进展之一,团队近年来致力于稳定、高效、可控的聚合物药物递送系统的制备,先后开发了工程化纳米凝胶、聚合物胶束、超分子组装体(Chemical Society Reviews, 2022, 51, 5136; Advanced Materials, 2022, 34, 2204034; Advanced Materials, 2022, DOI:10.1002/adma.202209379; Advanced Functional Materials, 2021, 31, 2100007; Advanced Science, 2022, 9, 2203353; Advanced Science, 2021, 8, 2101840; Advanced Healthcare Materials, 2022, 11, 2201233; Bioactive Materials, 2021, 6, 2894)等刺激响应性药物递送载体,为肿瘤等重大疾病的诊疗提供新思路。
论文链接:
https://doi.org/10.1016/j.nantod.2022.101727