近期,西南大学化学化工学院甄淑君教授、黄承志教授在ACS Nano上发表了题为“Self-Assembly of DNA Nanoflares in Mitochondria for Sensitive In Situ Imaging of Cancer Markers”的研究。

研究背景
线粒体作为关键细胞器之一,在调节包括癌症在内的重要生理和病理过程中发挥着至关重要的作用,是理解疾病机制和开发癌症疗法的重要研究目标。因此,及时观察线粒体状态和线粒体内癌症标志物水平对于临床诊断、治疗评估和预后至关重要。碱基切除修复是线粒体DNA修复的主要机制,人脱嘌呤/脱嘧啶核酸内切酶1 (human apurinic/apyrimidinic endonuclease 1, APE1)是其主要酶之一。研究表明,APE1的线粒体易位和线粒体功能调节、癌症治疗和肿瘤转移密切相关。近年来,通过光激活策略可以实现对线粒体APE1的时空选择性成像。然而,由于荧光发色团的流动性,对线粒体中的APE1进行灵敏的原位成像仍然具有挑战性。为了克服这一限制,作者利用DNA的可编程性构建了能够实时检测线粒体APE1的自组装纳米结构。
研究内容
本研究基于DNA分子的可编程性,构建了一种新型的线粒体定向递送与原位自组装响应机制,成功开发了一种用于线粒体内APE1酶原位成像的高灵敏策略。研究团队首先设计了一种嵌合DNA探针,其中包含可被APE1切割的识别序列以及可触发链式反应的引发区。该探针通过线粒体靶向基团(如三苯基膦)修饰后,被精确运输至线粒体内部。进入线粒体后,APE1特异性识别并切割探针,引发核酸链式反应(CHA, catalytic hairpin assembly),解锁回文结构序列,促使多个发卡结构发生级联开环与配对,最终自组装形成稳定的DNA纳米结构,该结构能够高效地富集并激发荧光信号,从而实现对线粒体APE1浓度变化的实时响应和信号放大。进一步的细胞实验证实,该系统在不同类型癌细胞与正常细胞中展现出显著的APE1水平差异识别能力,且可在氧化应激条件下追踪APE1的线粒体易位动态。荧光成像显示,系统在空间定位准确性和信噪比方面优于传统线粒体染料或直接探针标记策略,具备较高的亚细胞分辨率与成像稳定性。
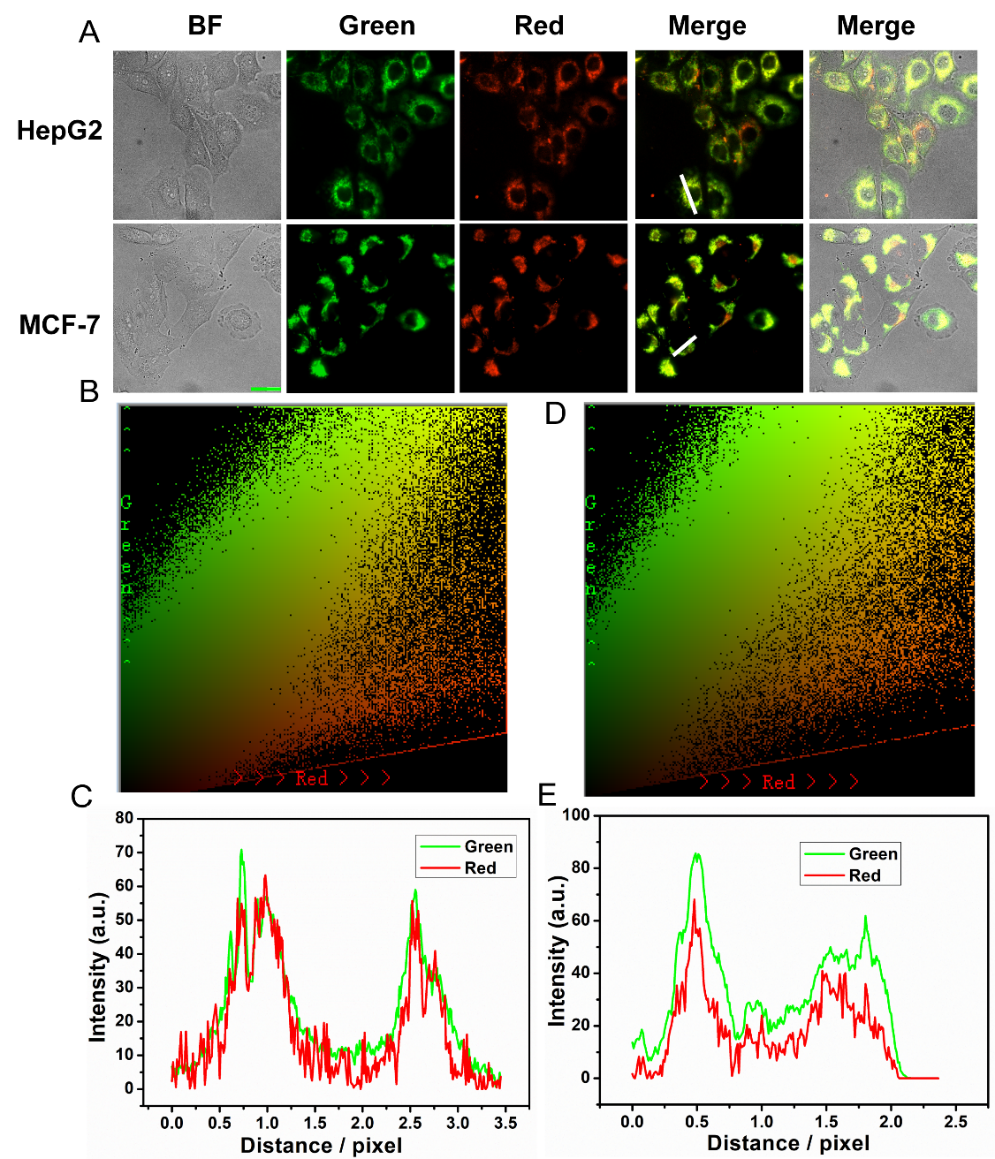
研究意义
该研究开发了一种用于线粒体中癌症标志物原位灵敏成像的空间组合链式反应,增强了在单细胞亚细胞水平精确定位APE1的能力,成功识别正常细胞和不同癌细胞,并能够在活细胞中以高空间分辨率监测氧化应激下APE1的线粒体易位,证明了联合链式反应实时监测细胞器内肿瘤标志物的能力。此外,APE1在空间上的位移和水平波动过程也密切影响细胞功能,对此类进程进行实时监控有助于更深入地了解癌症发生发展的分子机制。