2024年10月,重点实验室袁若、卓颖教授课题组联合厦门大学杨朝勇教授在《Angewandte Chemie International Edition》(IF 16.2)上在线发表了题为“Engineering of a Multi-Modular DNA Nanodevice for Spatioselective Imaging and Evaluation of NK Cell-Mediated Cancer Immunotherapy”的研究论文。

研究内容
自然杀伤(NK)细胞分泌的颗粒酶A(GzmA)作为评估癌症免疫治疗疗效的生物标志物近年来备受关注。然而,由于细胞种类多样、GzmA表达水平低以及GzmA探针的有限性,目前在NK细胞靶向治疗过程中选择性监测癌细胞中GzmA的空间分布极具挑战性。为此,我们开发了一种多模块、结构有序的DNA纳米装置(MODERN),用于评估NK细胞介导癌症免疫治疗的疗效。该纳米装置通过GzmA诱导无嘌呤/无嘧啶内切酶1(APE1)失活,实现了在癌细胞内对GzmA的空间选择性成像。
MODERN装置集成了多个功能模块,包括APE1门控识别模块、光激活放大模块、适配体介导的肿瘤靶向模块和多链环状DNA模块,从而大大提高了对细胞内GzmA的灵敏度和特异性。在癌细胞中,由于APE1的过表达,MODERN处于激活状态(信号开启);而在经NK细胞处理的癌细胞中,由于GzmA诱导的APE1失活,MODERN保持静默(信号关闭)状态。此外,我们还证明,GzmA诱导的APE1失活可以阻断靶细胞的损伤修复过程,导致高效的癌细胞死亡。
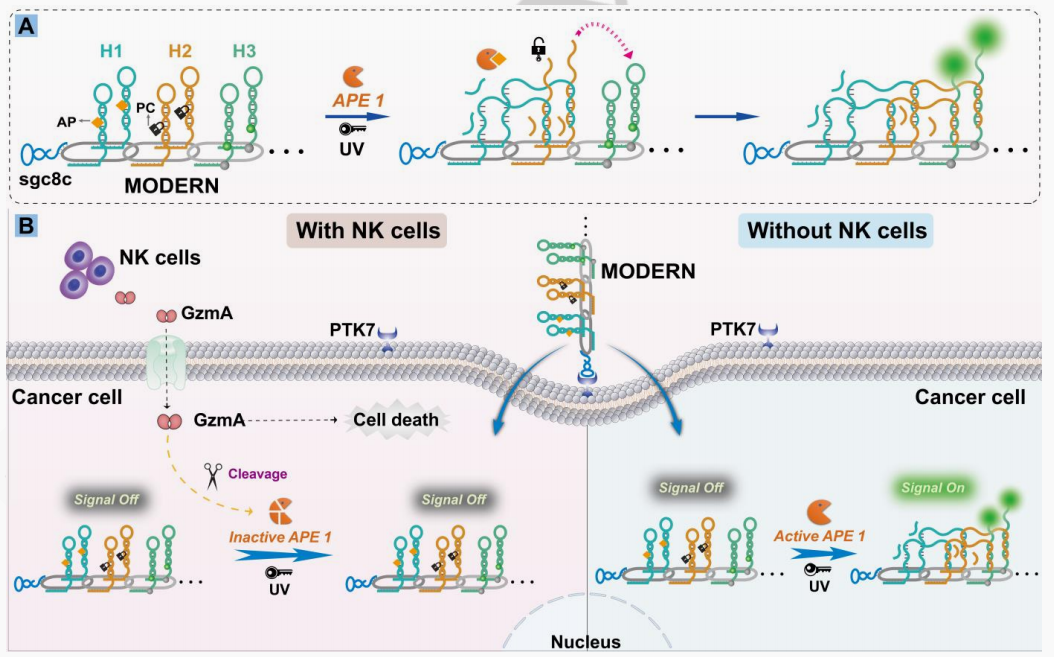
MODERN用于在NK细胞介导癌症免疫治疗过程中的癌细胞内空间选择性成像GzmA的示意图
研究意义
这种基于特异性GzmA失活APE1的纳米装置为评估癌症免疫治疗的疗效提供了一种新颖而有效的策略,不仅能够实现对癌细胞中GzmA的高灵敏度检测和空间选择性成像,还可以准确反映NK细胞介导的治疗效果。该装置通过多模块集成设计,克服了传统方法在区分活性和非活性颗粒酶以及获取细胞内时空信息方面的局限性。由于其在提高检测灵敏度、癌细胞特异性和提供空间选择性激活方面的显著优势,MODERN装置有望在临床癌症免疫治疗的疗效评估、个性化治疗方案的制定以及免疫治疗新药的开发中发挥重要作用,展现出广泛的应用前景。